
Лауреаты работали независимо друг от друга – Хондзё в Киотском университете, а Эллисон – в Калифорнийском университете в Беркли. Эллисон изучал белок, который работает как «тормоз» иммунной системы. Он предположил возможность управляемо отпустить этот тормоз так, чтобы иммунные клетки атаковали клетки опухоли. Хондзё открыл другой белок в иммунных клетках и, изучая его функции, показал, что он тоже действует как тормоз, но совершенно с другим механизмом.
Эти идеи легли в основу принципиально нового подхода к лечению онкологических пациентов. Фактически лауреаты впервые в истории предложили вариант борьбы с раком, в основе которого лежат не внешние воздействия – радио- или химиотерапия, – а мобилизация внутренних ресурсов нашего организма – иммунитета.
Как это?
Чтобы понять механизм этой терапии, нужно вернуться на несколько шагов назад и вспомнить, как вообще в нашем организме возникают раковые клетки. Инфекционные заболевания вызываются внешними агентами – бактериями и вирусами. Бактерии являются клетками сами по себе, вирусы – более мелкие образования, – но все же они чужеродны. Это позволяет иммунной системе в большинстве случаев распознавать их и уничтожать. Раковые клетки – это клетки организма самого человека, но мутировавшие.
Мутации происходят в наших клетках при делении постоянно, и наш организм обладает целым спектром механизмов избавления от «заболевших» клеток – от управляемой клеточной смерти, когда клетка «диагностирует» у себя нарушения и самоуничтожается, до той же иммунной системы. Фактически, атипичная клетка становится раковой именно тогда, когда приобретает способность обходить защитные барьеры, выстроенные организмом для самооздоровления. В частности, раковые клетки умеют «маскироваться» от иммунной системы.
Поэтому традиционно есть три способа борьбы с ними – хирургическое удаление, уничтожение с помощью того или иного типа излучения и медикаментозное воздействие. Нобелевская премия присуждена за реализацию изящной идеи – не борьбы с раковыми клетками как таковыми, а вооружения против них нашей собственной иммунной системы.
Кто они?
Один из лауреатов – японец из Киото, второй – американец из Техаса. Вот что рассказывает о них член комитета премии по физиологии и медицине, иммунолог, профессор Клас Шерре.
«Профессор Эллисон – ученый-иммунолог, он не врач. Он получил образование в биологии, которая интересовала его с детства. До работы по терапии рака он сделал массу интересных фундаментальных открытий в области регулирования иммунитета. Он не открыл «молекулу-тормоз», но именно он осознал ее потенциал для терапии», – сказал Шерре в интервью, опубликованном на сайте премии.
«Профессор Хондзё, – продолжает Шерре, – врач, у него есть степень доктора медицины. Но ему также принадлежат важные открытия в фундаментальной иммунологии, и он также изначально не работал в иммунологии рака. Когда он открыл свой механизм ингибирования иммунитета, это была фундаментальная работа, но в дальнейшем он смог осознать и ее практическое значение».
Секретарь комитета, профессор Томас Шерер, рассказал о реакции лауреатов на присуждение премии.
«Мне пока не удалось поговорить по телефону с профессором Эллисоном, но я дозвонился до профессора Хондзё. Я не знаю, ожидал ли он премии, но он показался мне, скорее, удивленным. И, конечно, ему было очень приятно получить премию, и он также подчеркнул, что ему приятно разделить ее с доктором Эллисоном», – сказал Шерер.
Уже в продаже?
«Награда присуждена вовремя. Первое лекарство, основанное на этой идее, было одобрено к применению в 2011 году. Пациентов лечат уже семь лет, и мы видим долгосрочные последствия, они более убедительны», – сказал Шерре.
Это действительно так. Иммунный «тормоз» – именно так описывают эксперты действие открытых белков – имеет богатую историю. Оба лауреата, как уже говорилось, изучали устройство иммунной системы. Ее фундаментальная особенность – умение отличать «своих» от «чужих» перед тем, как уничтожать «чужих».
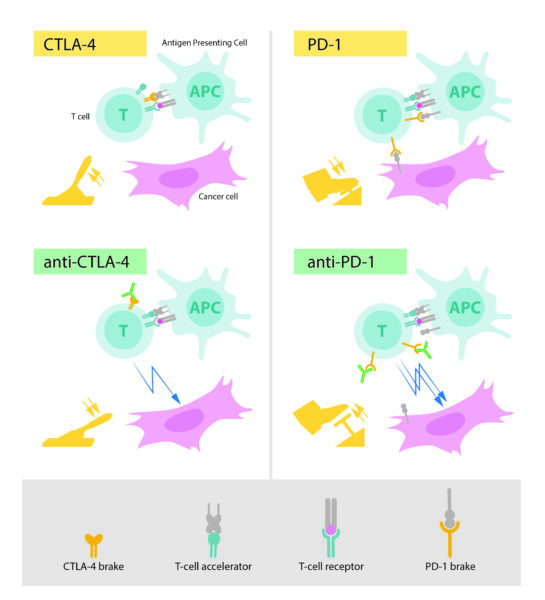
Ученые знали, что за распознавание «врага» отвечают Т-клетки иммунной системы – около 100 млн разных Т-клеток путешествуют по нашему телу и ищут в нем атипичные клетки. Рецептор (красная точка на рисунке) отвечает за распознавание инородной клетки. Ко-рецептор (обозначен желтым) ускоряет процесс. Однако это не вся система. Эллисон обнаружил, что система CTLA-4 работает как тормоз. Она взаимодействует с «ускорителем» и лишает иммунитет возможности действовать.
Первоначально этот механизм изучался в связи с аутоиммунными заболеваниями. Однако Эллисон разработал антитело, которое блокировало CTLA-4. Гипотеза о том, что эта блокировка высвободит Т-клетки и позволит им бороться с раковыми клетками, была подтверждена экспериментом в 1994 году в лаборатории Эллисона в Беркли. Это были эксперименты на мышах, для продвижения технологии необходимы были уже партнеры в сфере медицины.
Через несколько лет небольшая биотехнологическая компания согласилась произвести аналогичные антитела для человека, еще чуть позже начались клинические испытания. В 2011 году было одобрено первое лекарство – для неоперабельной метастазирующей меланомы. Независимо от Эллисона, в 1991 году в Университете Киото Хондзё обнаружил белок PD-1. Первоначально он не знал о его функции, однако впоследствии выяснилось, что и он работает как тормоз, но немного другим образом. Хондзё тоже обратился к фарминдустрии, и терапия на основе антител к PD-1 была одобрена для меланомы в 2014 году (два лекарства).
Все остальное – история. В 2015 году было одобрено еще два лекарства от меланомы, одно – от рака легких, одно – от рака почек. В 2016 году последовали ходжкинская лимфома, мочевой пузырь, шея, а после развитие стало лавинообразным. Клиническими исследованиями и выводом лекарств на рынок занимается бизнес, это уже не наука, как сказал сам Эллисон в своей лекции 2017 года.
Эллисон подчеркивает, что его исследованиями изначально двигало чистое научное любопытство – понять, как устроена иммунная система. И только после фундаментального открытия он предложил его практическое использование.
«Без фундаментальных исследований нам нечего было бы передать рынку, в бизнес. Хорошо бы, чтобы выделяющие деньги на науку в Национальном институте здоровья и прочие имели это в виду», – говорил ученый.
Иммунология рака – бурно развивающаяся область, и отмеченная премией терапия – не единственное ее достижение. Однако, отмечают эксперты, другие методики пока не столь убедительны. Они либо показывают результаты только на лабораторных животных, но не на человеке, либо не дают убедительных воспроизводимых результатов.
Кроме того, любые манипуляции с иммунитетом чреваты не всегда предсказуемыми и контролируемыми последствиями. «Большая часть токсичности связана с тем, что иммунная система начинает работать «без тормозов» и может не остановиться на уничтожении только опухолевой ткани (которая, в общем-то, достаточно похожа на клетки организма), но и начать уничтожать собственные здоровые клетки, что приводит к поражению тканей и органов. Применение онкоиммунологических препаратов может вызвать такие тяжелые осложнения, как аутоиммунные гепатиты, нефриты (воспаление ткани почек), тиреоидиты (воспаление ткани щитовидной железы) и другие. Эти воспаления обусловлены не внешним воздействием, а работой гиперактивированной иммунной системы, направленной на свои же клетки», – поясняет врач-онколог, резидент Высшей школы онкологии Полина Шило.
Премия по физиологии и медицине является одной из пяти премий, учрежденных самим Альфредом Нобелем: премии присуждаются за выдающиеся достижения в химии, физике, литературе, в физиологии или медицине и за вклад в установление мира. Первую Нобелевскую премию по физиологии или медицине вручили в 1901 году. Россияне получали эту премию только дважды – это были Иван Павлов (за работы по физиологии пищеварения) и Илья Мечников (за работы по иммунитету). Обе награды были получены более 100 лет назад.
На этой неделе будут объявлены и другие лауреаты Нобелевской премии 2018 года – во вторник по физике, в среду – по химии, в пятницу – премия мира. В этом году из-за репутационного скандала в комитете Нобелевская премия по литературе вручаться не будет.


